![Gakuen Heaven 2: Double Scramble - [20/193] - [Tomo route: June 3]](https://i.ytimg.com/vi/t9RsK1Jqu60/hqdefault.jpg)
Contido
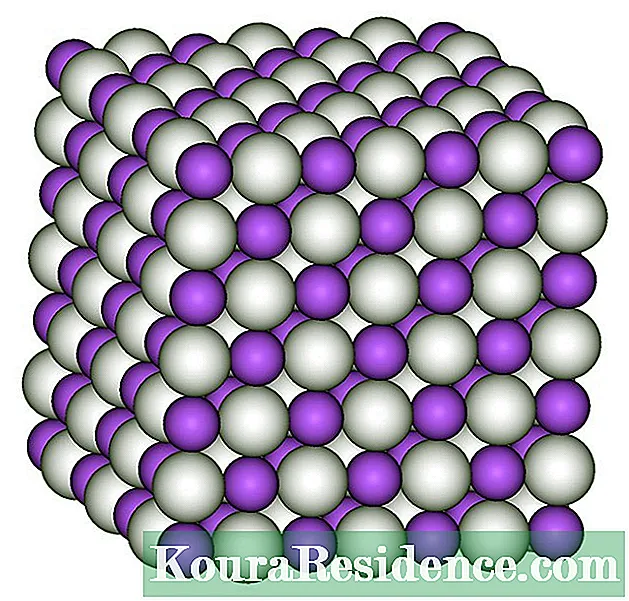
Co nome de átomo a unidade mínima do elementos químicos, que ten a súa propia existencia e tamén é indivisible. O átomo é a partícula base de toda a materia coñecida e está presente en todas as cousas, tanto nos seres vivos como nos obxectos inertes.
A caracterización de átomo indivisible Non é pola imposibilidade de que o átomo se divida, senón que no caso de dividirse perdería o seu propiedades químicas: o átomo está formado por partículas aínda máis pequenas, o coñecido partículas subatómicas.
Composición
En efecto, a composición do átomo inclúe un centro composto por un núcleo que contén protóns e neutróns e varias cunchas exteriores que teñen as partículas subatómicas máis pequenas de átomos, os electróns.
Mentres que o electróns ter unha carga negativa, protóns igual carga eléctrica pero positiva e a neutróns non teñen ningún cargo. O modelo de cargas e capas eléctricas foi desenvolvido por Bohr e funciona ben para explicar os lazos entre os diferentes átomos.
Propiedades
O átomo sempre ten algunhas propiedades, que son útiles para comprender as agrupacións que forman, así como as diversas organizacións. O átomo sempre ten un número atómico (representado pola letra Z) que explica o número de protóns que contén, que é igual ao dos electróns. Tamén ten un número de masa, representado pola letra A, que se refire á suma de protóns e neutróns que o elemento contén no seu núcleo.
Clasificación
Existen diferentes clases de átomos e a clasificación máis común é a que se realiza no táboa periódica dos elementos, que divide os átomos segundo o seu número atómico: o único elemento que ten un único protón no núcleo é o hidróxeno.
Estes elementos tamén adoitan clasificarse entre os metais, que tenden a perder electróns do seu último caparazón e logo a formar o que se coñece como ións positivos sen metais que pola contra aceptan electróns na súa última capa formando ións negativos.
Historia da teoría atómica
O teoría atómica entendendo estes elementos como a unidade mínima da estrutura da materia existe desde a Antiga Grecia, e ademais de Bohr Incluíu un gran número de químicos que aportaron preguntas sobre o estudo.
En 1803, John dalton Modelou o átomo mostrando que a unión entre eles se fixo a través de certas proposicións definidas. John Thomson, pola súa banda, determinou as cargas positivas e negativas e a conformación dos ións de ambos signos. O seguinte entre os predecesores de Bohr foi Rutherford, o que explicou a cuestión dos diferentes niveis e capas electrónicas.
Os modelos sucedéronse ata os estudos actuais do Teoría cuántica, principalmente orientada aos campos. Obviamente, é certo que a estrutura do núcleo atómico e das partículas que o compoñen é moito máis complicada que a tradicional estrutura electrónica dos átomos.
A continuación, a lista completa dos elementos da táboa periódica, que constitúen a totalidade dos átomos constituídos.
| Actinio | Disprosio | Magnesio | Rodio |
| Aluminio | Dubnio | Manganeso | Roentgenio |
| Americio | Einsteinio | Meitnerius | Rubidio |
| Antimonio | Erbio | Mendelevio | Rutenio |
| Argón | Escandio | Mercurio | Rutherfordio |
| Arsénico | Estaño | Molibdeno | Samario |
| Astatus | Estroncio | Neodimio | Seaborgio |
| Xofre | Europium | Neón | Selenio |
| Bario | Fermio | Neptunio | Silicio |
| Berilio | Flerovio | Niobio | Sodio |
| Berkelium | Flúor | Níquel | Talio |
| Bismuto | Partido | Nitróxeno | Tántalo |
| Bohrio | Francius | Nobelio | Tecnecio |
| Boro | Gadolinio | Ouro | Teluro |
| Bromo | Galio | Osmio | Terbio |
| Cadmio | Xermanio | Osíxeno | Titanio |
| Calcio | Hafnio | Paladio | Torio |
| Californium | Hassio | Prata | Tulio |
| Carbono | Helio | Platino | Ununoctium |
| Cerio | Hidróxeno | Chumbo | Ununpentium |
| Cesio | Ferro | Plutonio | Ununseptio |
| Zinc | Holmio | Polonio | Ununtrio |
| Circonio | Indio | Potasio | Uranio |
| Cloro | Iridium | Praseodimio | Vanadio |
| Cobalto | Criptón | Promesa | Volframio |
| Cobre | Lantano | Protactinio | Xenon |
| Copérnico | Lawrencio | Radio | Iodo |
| Chrome | Litio | Radón | Iterbio |
| Curium | Livermorio | Renio | Ytrio |
| Darmstadtium | Lutecio |